نُشر هذا المقال بالإنجليزية في مجلة نيتشر بتاريخ 4 نيسان 2023.
عندما صعدت طبيبة الأعصاب ريسا سبيرلنغ لتستلم جائزة الإنجاز مدى الحياة في مؤتمر دوليّ لمرض آلزهايمر في كانون الأول الماضي، كانت متحمسة بشأن المستقبل أكثر من الاحتفال بالماضي.
ما أبهج سبيرلنج، التي فازت بالجائزة عن عملها في التجارب السريرية لعلاجات آلزهايمر، هو الإحساس بالأمل، الذي كان مفقودًا بشكل واضح في أبحاث هذا المرض لسنوات عديدة. وهو إحساس شعر به الحاضرون كذلك.
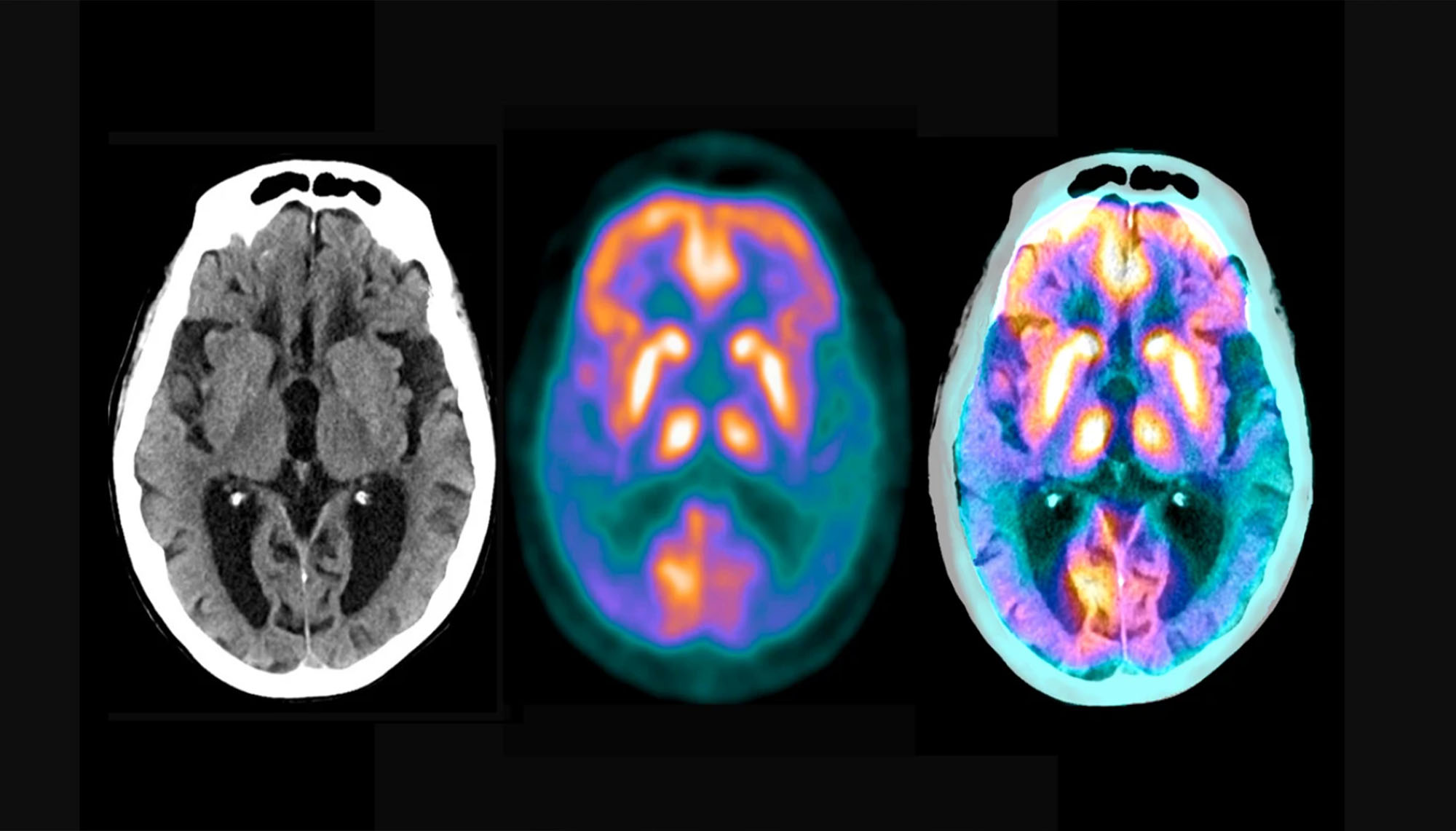
قبل بضعة أشهر فقط من ذلك الاجتماع، أعلن باحثون أن عقارًا يسمى ليكانيماب (Lecanemab) تمكّن بوضوح من خفض كمية صفائح بروتين الأميلويد، الذي يمثل علامة دالّة على وجود المرض، في أدمغة المشاركين في تجربة سريرية، وأبطأ تدهورهم الذهني.
كانت سبيرلنغ، التي تدير مختبرًا في كلية الطب بجامعة هارفارد في بوسطن، مبتهجة بينما تمسك الميكروفون بإحكام. قالت إنه بعد قضاء أكثر من ثلاثين عامًا محبطًا في أبحاث مرض آلزهايمر، أخيرًا هناك دليلٌ على أنها وزملاءها على المسار الصحيح. «لكن مع ذلك، هذا لا يكفي» حسب قولها.
في التجربة السريرية، أدّى العلاج إلى إبطاء التدهور بنسبة 25%، وهو ما يكفي لمنح المشاركين بضعة أشهر إضافية من العيش باستقلالية. «لكن قهر مرض مدمّر يصيب عشرات الملايين من الناس في جميع أنحاء العالم فعلًا هو قصة مختلفة»، تقول سبيرلنغ.
علاوة على ذلك، فإن نظام العلاج باستخدام ليكانيماب، الذي سُوّق في الولايات المتحدة باسم ليكمبي (Leqembi)، قاسي. يجب أن يُضخّ العقار من خلال الوريد بواسطة أخصائي تمريض، ولأن الدواء يمكن أن يسبب تورمًا في المخ ونزيفًا يهدد الحياة، يجب مراقبة الأشخاص الذين يتلقونه بانتظام.
وافقت إدارة الغذاء والدواء الأمريكية في عام 2021، على جسم مضاد شبيه، اسمه أدوكانوماب (Aducanumab)، لكن القرار أثار جدلًا لأن التجارب السريرية للعقار لم تظهر فائدة قطعيّة.
رغم هذه التفاصيل، عززت نتائج ليكانيماب الأمل في إمكانية الوقاية من مرض آلزهايمر في المستقبل، إذا قدّم العلاج في وقت مبكر بما فيه الكفاية. أثار النجاح أيضًا احتمالًا آخر: يمكن استخدام هذه الأدوية مع الأدوية المستقبلية لمعالجة مراحل مختلفة من المرض، والتي غالبًا ما تحكمها جزئيات مختلفة. قلّة يتوقعون أن يكون علاج فرديّ هو الحل، لكنّ تجارب العلاج المركّب باهظة الثمن ومعقدة، إذ يجب اختبار كل دواء بمفرده ومع الأدوية الأخرى. ويمكن لشركات الأدوية أن تخاف من ربط منتجها بآخر، في حالة فشل التركيبة وانعكاس ذلك على عقارها.
إن مزاج الثقة المتزايدة بين العاملين في هذا المجال لا يرجع فقط إلى نجاح الأجسام المضادة للأميلويد. ولكن لأن لدينا العديد من العلاجات الجديدة المحتملة، ناهيك عن الأدوية التي كانت مهجورة ويتم اليوم النظر في أمرها من جديد.
تراكيب واعدة
داء آلزهايمر له بداية طويلة وصامتة. أولًا، تبدأ الصفائح، المكوّنة من كتل من بروتينات أميلويد بيتا اللزجة، بالتجمّع في الدماغ. وسرعان ما تصبح محاطةً بخلايًا مناعية تسمى الخلايا الدبقية الصغيرة، التي تحاول قضمها للتخلص منها، لكنها تفشل في النهاية. تنمو الصفائح من حيث الحجم والعدد من دون أن تُلاحظ لسنوات، أو حتى لعقود، وهو ما يتسبب في تراكم بروتين آخر، يسمى تاو، وانتشاره حول الدماغ بشكل متشابك.
لا يزال العلماء يعملون على تحديد كيفية حدوث هذه السلسلة من الأحداث بالضبط، لكن الأعراض الذهنية لا تبدأ في الظهور إلا بعد حدوث كل ذلك، وترتبط شدة الأعراض بمدى تشابك بروتين تاو.
العلاجات الفردية الموجّهة التي تستهدف بروتين تاو لم تحقق أداءً جيدًا حتى الآن في التجارب. لكن العلماء يعتقدون أن هذه الأدوية قد تعمل بشكل أفضل عند استعمالها مع علاج مضاد للأميلويد.
يقول راندال بيتمان، طبيب الأعصاب في جامعة واشنطن: «نحن نعلم أن الأميلويد يقود بطريقة ما تراكم بروتين تاو المرضيّ، والذي ينتشر بعد ذلك عبر الدماغ كالنار في الهشيم. لذلك نعتقد أن من المنطقي إزالة المادة التي تغذي ألسنة اللهب، بينما نحاول إخماد نيران تشابك تاو».
بدأ بيتمان وزملاؤه التخطيط لمثل هذه التجربة عام 2015، لكنها أصبحت ممكنة مؤخرًا فقط، بعد ظهور الدلالات الأولى على فاعلية علاجات الأميلويد. وفي العام الماضي، أطلقوا تجربة دولية تعرف باسم تاو نكسجن (Tau NexGen). لقد استقدموا 168 مشاركًا من المحتمل أن يصابوا جميعًا بمرض آلزهايمر في سن مبكرة، عادةً في الثلاثينيات أو الأربعينيات أو الخمسينيات من العمر، لأن لديهم طفرة جينية تؤدي إلى زيادة إنتاج الأميلويد بيتا.
يقسم المشاركون إلى مجموعتين، وفقًا لما إذا كان لديهم بالفعل أعراض الخرف أو من المتوقع أن تظهر عليهم الأعراض في السنوات العشر القادمة، وعادةً ما تظهر الأعراض على هؤلاء الأشخاص في نفس العمر التي ظهرت فيه عند من ورثوا منه الطفرة.
لدينا اليوم العديد من العلاجات الجديدة المحتملة لآلزهايمر، والتي تعمل بطرق مختلفة، ناهيك عن الأدوية التي كانت مهجورة ويتم اليوم النظر في أمرها من جديد.
سيتلقى جميع المشاركين ليكانيماب وجسمًا مضادًا لبروتين تاو، ولكن بترتيبات مختلفة. أولئك الذين ليس لديهم أعراض سيتلقون الجسم المضاد لبروتين تاو المسمى E2814 لمدة عام، ثم يضاف ليكانيماب، بينما ستتلقى المجموعة الأخرى ليكانيماب لمدة ستة أشهر ثم يضاف E2814. يأمل الباحثون الذين يديرون التجربة أن يتمكنوا من استخدام هذه التركيبات لمعرفة ترتيب العلاج الأفضل. وسوف تُضاف بعدها المزيد من الأدوية المضادة لبروتين تاو إلى الدراسة، ومن المتوقع ظهور النتائج الأولى للتجربة بعد عام 2027.
تاو نكسجن هي التجربة السريرية الأولى والوحيدة حتى الآن للعلاج المركب للزهايمر. ويتم التخطيط لتجربة مماثلة في الولايات المتحدة لمرض آلزهايمر المتقطع متأخر الظهور، والذي يصيب كبار السن ويمثل الغالبية العظمى من الحالات. من المتوقع أن تُقرّر معاهد الصحة الوطنية الأمريكية (NIH) في الأشهر القليلة المقبلة ما إذا كانت ستشارك، مع قطاع الأدوية الخاصة، في تمويل هذه التجربة، التي يطلق عليها تجربة ATP. إذا حدث ذلك، فقد يبدأ تعيين [المتطوعين] العام المقبل.
تُطوّر العديد من شركات الأدوية والتكنولوجيا الحيوية علاجات مضادة لبروتين تاو، بعضها كأجسام مضادة، والبعض الآخر يستخدم جزيئات صغيرة أخرى أو أساليب وراثية أحدث لمنع إنتاج الأشكال المَرضيّة من بروتين تاو. يقول آدم بوكسر، طبيب الأعصاب في جامعة كاليفورنيا بسان فرانسيسكو، والرئيس المشارك لتجربة ATP، إن العديد من هذه الشركات أبدت اهتمامًا رسميًا بالمشاركة.
مثل تاو نكسجن، سيكون هذا نوع من التجارب الوقائية. سيكون لدى المشاركين أعراض قليلة أو معدومة، ولكن ستكون هناك أدلة من المسوحات واختبارات الدم على أن أدمغتهم تحتوي على صفائح وعلامات مبكرة لتشابك بروتين تاو. سيكون هناك حوالي 900 مشارك في ست مجموعات، وسيحصلون على أحد علاجي بروتين تاو إما بمفرده أو مع ليكانيماب أو سيحصلون على ليكانيماب وحده أو سيحصلون على دواء وهمي. تأمل فرق البحث أن يعزز العلاج المضاد لبروتين تاو الفوائد المتواضعة لليكانيماب، وأن يؤدي ليكانيماب بدوره، من خلال تقليل عبء الصفائح، إلى خلق ظروف تزيد فاعلية العلاج المضاد للتاو.
مفتاح التجارب سيكون مجموعة من قياسات المؤشرات الحيوية الجديدة الحساسة للدماغ أو الدم والتي تعطي قراءة لحالة المرض. تُراقِب فحوصات الدماغ وجود وشدة صفائح الأميلويد وتشابكات بروتين تاو، أما اختبارات الدم أو السائل النخاعي فتقيس العديد من الجزيئات الأخرى في السلسلة المرضيّة، مثل الأشكال المختلفة من الأميلويد والتاو. يتوقع الباحثون أن البيانات الجزيئية والسريرية الشاملة التي ينتجونها ستساعد في الكشف عن المزيد حول آليات مرض آلزهايمر. يقول بوكسر: «تشير الأدلة حتى الآن إلى أن بروتين تاو هو ما يبدأ أعراض مرض آلزهايمر، والإعاقات المرتبطة به التي تؤدي للموت في النهاية. لكن هذه الفرضية تحتاج إلى اختبارها على البشر».
إلا أن تجارب العلاجات المركبة لها بعض العيوب: فهي مكلفة وإدارتها معقدة. يُقدّر بوكسر أن تجربة ATP ستكلّف مئات الملايين من الدولارات، رغم المؤشرات الحيوية الجديدة، التي تجعل التجارب أكثر كفاءة.
إن الأجسام المضادة نفسها علاجات باهظة الثمن. سيتم تسويق عقار ليكانيماب بسعر 26,500 دولار أمريكي للعلاج لمدة عام. وتم تسعير أدوكانوماب (الذي بيع باسم أدوهلم (Aduhelm) في الولايات المتحدة) في الأصل بمبلغ 56 ألف دولار للعلاج لمدة عام واحد، لكنّ صانعي المنتج خفّضوا السعر إلى النصف بعد الاحتجاجات العامة على ذلك.
تلقّي هذه الأدوية مجهدٌ للمرضى أيضًا، إذ يجب تلقيها كل بضعة أسابيع. تُشير البيانات المستمدة من التجارب السريرية إلى أن العلاج مدى الحياة سيكون مطلوبًا لمنع تطور مرض آلزهايمر، كما يقول طبيب الأعصاب بول أيسن، من جامعة جنوب كاليفورنيا، وهو رئيس اتحاد التجارب السريرية لمرض آلزهايمر في الولايات المتحدة. «يبدو أن المرض ينتعش عندما تتوقّف الحقن». ونظرًا لأن العلاج طويل الأمد بالأجسام المضادة غير عملي، كما يقول، «فنعتقد أنه قد يكون من المنطقي الحفاظ على حالة منخفضة من الأميلويد باستخدام دواء يؤخذ عن طريق الفم يمنع إنتاج أحماض الببتيد» فور تمكن الأجسام المضادة من إزالة الصفائح.
هذه المركبات موجودة. وبدءًا من عام 2010 تقريبًا، جرب الباحثون مجموعة من الأدوية الفموية التي تهدف إلى تقليل الأميلويد في الدماغ عن طريق ضبط أنشطة أحد الإنزيمين المسؤولين عن إنتاجه، بيتا سيكريتاز (β-secretase) أو غاما سيكريتاز (γ-secretase). لكن التجارب السريرية لهذه الأدوية فشلت جميعًا، وتلاشى الاهتمام بها، حتى أُتيحت لها فرصة ثانية.
مكوناتٌ أخرى
في عام 2018، وافقت مجموعة من شركات الأدوية على القيام بشيء غير معتاد في صناعتها السرية عادة، عندما قرروا مشاركة البيانات السريرية السرية من ست تجارب فاشلة مع بعضهم البعض ومع مجموعة مختارة من المتخصصين الذين جمعتهم جمعية مرض آلزهايمر، وهي مجموعة ضغط لحقوق المرضى ومقرها في شيكاغو.
أرادت الجمعية أن تتعلم قدر الإمكان من التجارب السريرية كارثية النتائج، والتي اختبر كل منها مثبطًا مختلفًا لإنزيم بيتا سيكريتاز. لم يُظهر أي من الأدوية فعالية، والأسوأ من ذلك، كان للعديد منها آثار جانبية خطيرة، بما في ذلك، في بعض الحالات، تدهور الإدراك لدى المرضى. بدلًا من ترك بيانات التجربة ليعلوها الغبار خلف الأبواب المغلقة، أرادت الجمعية مناقشتها بالتفصيل. كان الهدف، كما تقول ماريا كاريلو، كبيرة المسؤولين العلميين في الاتحاد، «مساعدة [العاملين في] المجال على فهم المزيد عن البيولوجيا المرتبطة بالأمراض التي تستهدفها هذه العقاقير البحثية».
تشير الورقة البحثية التي أعدتها اللجنة، والتي نُشرت في عام 2021، إلى أن المرض ربما كان متقدمًا جدًا لدى المشاركين في التجربة مما جعل الأدوية عاجزة عن تحسين الأعراض، وأن الجرعات المنخفضة منها يمكن أن تتغلب على مشكلة الآثار الجانبية.
ويعتقد بول أيسن أنه من الممكن استخدام هذه الأدوية بجرعات منخفضة لمنع عودة الصفائح، بمجرد إزالة الصفائح الموجودة باستخدام الأجسام المضادة.
فشلت أيضًا مجموعة من التجارب السريرية التي تستهدف إنزيم غاما سيكريتاز. ولكن بدلًا من التخلي عن هدفهم، كان الباحثون يعملون على نهج أكثر دقة. فبدلًا من منع الإنزيم تمامًا، ما يساهم في الآثار الجانبية التي لوحظت في التجارب، هم يأملون في تغيير سلوكه.
سيتم اختبار أحد هذه المُعدِّلات، وهو مركّب طُوّر في تعاون أكاديمي، في تجربة سريرية مبكرة هذا العام. هذا الدواء، الذي يمكن تناوله عن طريق الفم، يجعل الإنزيم يقطع الأميلويد إلى بروتينات أقصر، غير سامة، ويمكن أن تكون واقية.
تستهدف معظم الأدوية التي يُنظر فيها للتجارب المركبة الأميلويد أو بروتين التاو. ولكنّ هناك مناهج لا تزال في مراحل مبكرة تسعى إلى تحسين آليات الدفاع المناعي الطبيعية للدماغ ضد داء آلزهايمر. مرة أخرى، تعلّم الباحثون الكثير من العائلات التي لديها طفرات جينية تجعلهم عرضة للإصابة بمرض آلزهايمر.
الطفرة المعنيّة هنا موجودة في جين يسمى TREM2، والتي تصنع جزيئًا يجلس على سطح محاربي الجهاز المناعي في الدماغ؛ الخلايا الدبقية الصغيرة. يقول عالم الأعصاب كريستيان هاس في جامعة لودفيج ماكسيميليان في ألمانيا إن «ضبط الخلايا الدبقية الصغيرة يمكن أن يجعلها أكثر كفاءة في إزالة الصفائح أو منع انتشار أمراض الأميلويد، خاصةً إذا جرى تقليل حمل الصفائح لأول مرة باستخدام العلاج المضاد للأميلويد». وهو يخطط لإجراء تجارب على الفئران لاختبار كيفية عمل الجسم المضاد الذي يربط TREM2 وينشّط الخلايا الدبقية الصغيرة إذا تم تناوله جنبًا إلى جنب مع العلاج المضاد للأميلويد. ويوجد جسم مضاد مماثل في مرحلة مبكرة من التجارب السريرية كعلاج منفرد أيضًا.
اللقاحات والجينات والبلازما
تشقّ المزيد من الأساليب لاستئصال مرض آلزهايمر طريقها إلى التجارب السريرية. يهدف الباحثون إلى إيصال جزيئات مفيدة إلى الدماغ من خلال اللقاحات أو ناقلات الفيروس أو عمليات نقل الدم. ويُعاد اختراع اللقاحات، مثل عقاقير الإنزيم، بعد فترة طويلة من توقف التجربة السريرية الأولى للقاح مضاد للأميلويد في عام 2002، عندما لوحظ التهاب الدماغ لدى بعض المشاركين.
يوجد الآن العديد من اللقاحات المضادة لبروتين تاو والمضادة للأميلويد قيد التحضير أو في مراحل مبكرة من التجارب السريرية. تتألف هذه اللقاحات من شذرات من بروتينات تاو أو بروتين بيتا أميلويد لتجنب الاستجابات الالتهابية الخطيرة. وهي مصممة لتحفيز جهاز المناعة في الدماغ للتعرّف على النسخ الكاملة للبروتينات وتدميرها، وكان الغرض منها في الأساس منع المرض أو إبطاء تقدم المرض المبكر. ويحاول العلماء أيضًا تطوير لقاحات لمهاجمة كل من بروتين تاو وأميلويد بيتا. ويراهن باحثون آخرون على العلاج الجيني للتغلب على أشكال مرض آلزهايمر التي تسببها الطفرات الجينية.
من السابق لأوانه الجزم بنجاح أيٍ من هذه العلاجات الجديدة المحتملة. يعتقد معظم الباحثين أن العلاج يجب أن يكون حسب كل حالة، وبالتالي سيحتاج الأفراد في مراحل المرض المختلفة إلى علاجات مختلفة.
تؤثر الأشكال المميزة لجين صميم البروتين الشحمي E، أو APOE ، الذي يشّفر بروتينًا يشارك في عملية التمثيل الغذائي للدهون، في خطر الإصابة بمرض آلزهايمر بطرق مختلفة. يرتبط البديل الجيني APOE4 بزيادة المخاطر، بينما يقللها البديل APOE2. في تجربتها المفتوحة، والتي تلقى فيها جميع المشاركين العلاج، قامت شركة ليكسو (Lexeo Therapeutics)، باستقطاب 15 متطوعًا يعانون من أعراض خفيفة من مرض آلزهايمر ولديهم نسختان من جين APOE4. لقد أرادوا اختبار ما إذا كان تلقي المتغير الجيني APOE2 سيخفف من التأثير الضار للنسخة عالية الخطورة. لذلك قاموا بربط الجين بناقل فيروسي، ثم قاموا بحقنه مباشرة في السائل النخاعي للمتطوعين.
يبدو أن التطعيم الجيني كان ناجحًا. أفادت ليكسو العام الماضي أنه تم اكتشاف جين APOE2 في السائل الشوكي لبعض المشاركين لمدة تصل إلى عام بعد الحقن، وأنه لم تُلاحظ أي آثار جانبية خطيرة حتى الآن وأن مستويات بروتين تاو لدى المشاركين قد انخفضت. من السابق لأوانه تقييم ما إذا كان تقدم المرض قد تباطأ نتيجة لذلك، ولكن سيرَاقب المشاركون حتى عام 2028.
لن يكون العلاج الجيني مناسبًا للجميع، لأن الطفرات الجينية المعروفة تشكل نسبة صغيرة فقط من حالات مرض آلزهايمر. لكن العديدين تبنّوا مفهوم العلاج باستخدام الهرمونات البديلة. أكملت شركة الكاهست (Alkahest)، تجربة سريرية صغيرة لاختبار ما إذا كانت العوامل في دماء الشباب يمكن أن تحلّ محل العناصر المفقودة في عملية الشيخوخة.
ووجد بعض الباحثين نجاحًا مع الأساليب منخفضة التقنية. على سبيل المثال، أظهرت تجربة كبيرة مضبوطة بعناية أن 18 شهرًا من التمارين الهوائية أو تمارين التمدد أوقفت التدهور الذهني لدى الأشخاص الذين يعانون من ضعف إدراكي خفيف، وهو ما يبرز قيمة الحفاظ على نظام تمارين أثناء العلاج الدوائي.
من السابق لأوانه الجزم بنجاح أيٍ من هذه العلاجات الجديدة المحتملة. يعتقد معظم الباحثين أن العلاج يجب أن يكون حسب كل حالة، وبالتالي سيحتاج الأفراد في مراحل المرض المختلفة إلى علاجات مختلفة. يقول أيسن: «إنه لأمر رائع أن نرى هذا العدد الكبير من الأساليب المعقولة التي يُنظر فيها. ولكنّ أمامنا طريق طويل». ومع ذلك، فإن مجموعة الخيارات التي تخضع للاختبارات السريرية مشجّعة، كما تقول سبيرلينغ. «وبصيص نجاحنا الجديد يدفعنا إلى الأمام».